人生就是博-尊龙凯时提供了对E. coli HCP产品性能的对比分析,背景涵盖了生物药物生产的历史。近十年来,针对药物终产物中HCP杂质的有效去除和检测,取得了大量研究成果。这些杂质的存在对临床病人的安全性和药物的稳定性产生了深远的影响。
目前,广泛使用的蛋白药物表达系统包括原核表达系统(如大肠杆菌E. coli)、植物表达系统、真菌表达系统(如毕赤酵母和酿酒酵母)、昆虫表达系统(如慧飞蛾细胞SF9)以及哺乳动物细胞表达系统(如中国仓鼠卵巢细胞CHO和非洲绿猴肾细胞Vero)。在这些系统中,哺乳动物细胞系统因其应用广泛但价格昂贵,而E. coli表达系统则因产量高且成本低位于蛋白表达的首选。
E. coli表达系统因培养简易、转化效率高以及高产量等优势,被广泛应用于不需要糖基化修饰的人胰岛素和生长激素的生产。此外,尽管某些蛋白(如α、β和γ-干扰素,以及白介素2和肿瘤坏死因子)在自然状态下需进行糖基化修饰,但在不糖基化的情况下依然保留生物学活性。
HCP的检测和鉴定方法中,ELISA和LC-MS法是目前的金标准。前者在高通量定量方面具有低成本优势,后者则具有定量和定性双重能力,但价格较高且通量较低。因此,两种方法应正交组合,以确保对药物中HCP的准确定性和定量。
研究表明,不同药物采用相同纯化工艺或同一药物的不同工艺中,HCP残留水平差异显著,导致国内外的药物HCP定量结果不一致。E. coli HCP与CHO HCP的差异主要包括以下几类:粘附素(如Curli)、毒素(如α-溶血素)、侵袭素(如OmpA)、免疫逃逸相关蛋白(如LPS)、分泌系统效应蛋白(如EspC)以及宿主相互作用效应蛋白(如NleH)等。
据Jones等研究,残留的HCP不仅具有免疫原性,还可能影响药物辅料的降解。此外,通过基因敲除宿主菌/细胞中的高风险因子,或对空载HCP模拟药物生产与纯化流程,尤其在深层过滤、亲和纯化等步骤中的HCP残留分析至关重要。在药物纯化的优化过程中,常常会遇到难以去除的HCP。据Zhu等的报道,E. coli表达的疟疾疫苗在纯化过程中的HCP含量范围为90 ng 或 <1100 ppm/剂,但临床可接受的不致使慢性疾病形成的HCP含量仅限于<100 ppm/剂。
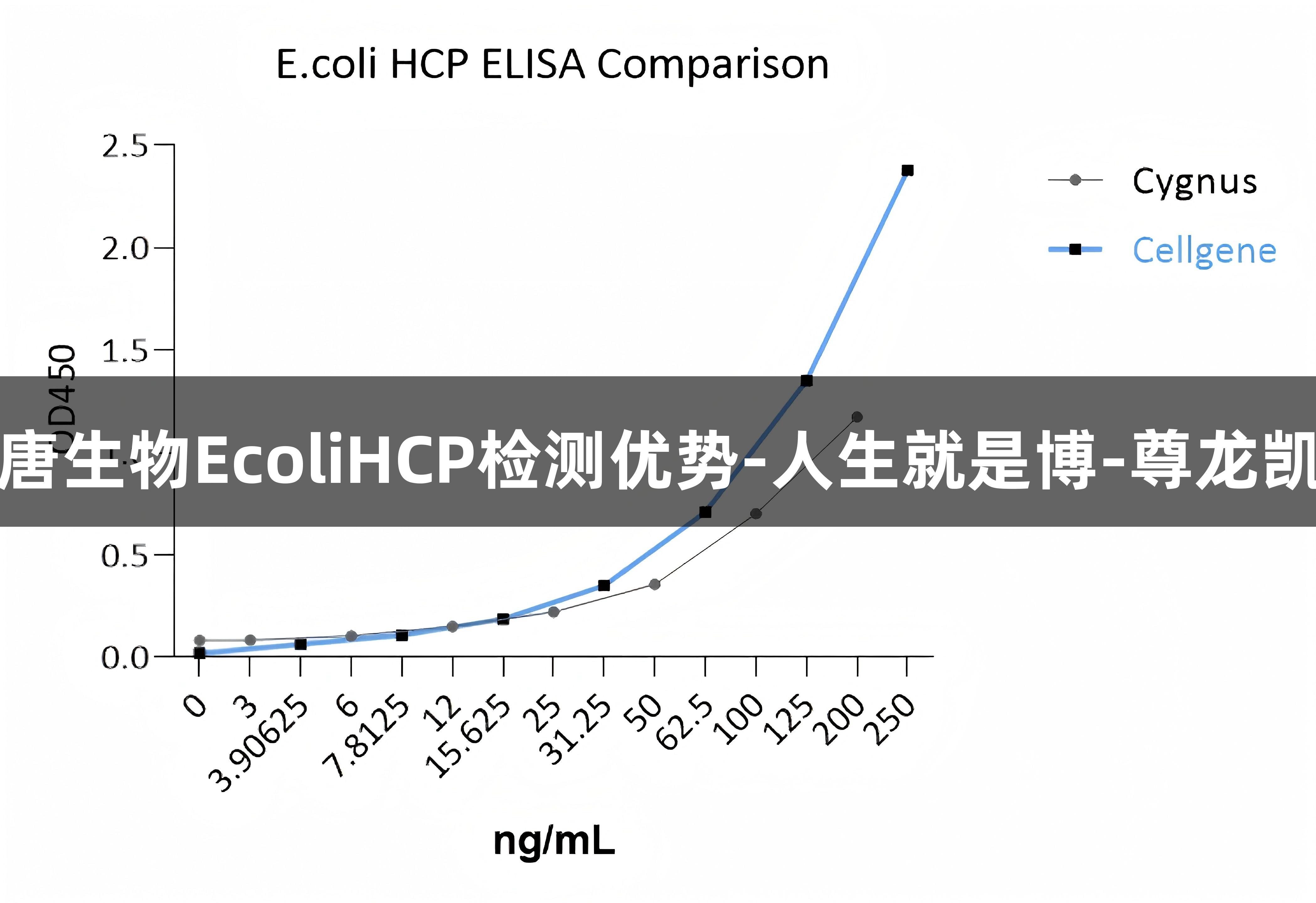
因此,有必要全面检测HCP以防止漏检,并不断提升检测的灵敏度和覆盖度。赛唐生物新开发的E. coli HCP(6S) ELISA/EH-E0022-3与美国Cygnus/F410产品进行了比较,经过以下几个方面进行评估:标准曲线范围、样本相对变化率、样本检测浓度和背景信号。以下是优势的具体表现:
- 背景信号较低,减少非特异性结合的可能性;
- 样本相对变化率更加稳定,检测区间更广;
- 样本的检测浓度更高。
人生就是博-尊龙凯时专注于生物医药工业检测领域已有15年,致力于HCP残留检测系列产品的研发,以及提供HCP专属性抗体制备和覆盖度分析等技术服务。借助核心技术与服务的不断创新,我们力求在生命科学和生物制药领域中持续贡献卓越的检测方案,推动人类健康事业的发展。

